Общеизвестно, что если не принимать определенных мер, то кузов автомобиля в течение четырех-пяти лет может превратиться буквально в ржавое решето. Зачастую не помогают ни лакокрасочные покрытия, ни мастики, поскольку кузов имеет немало закрытых полостей, пазух, карманов, коробов, в которых дорожная грязь и сырость, замешанные на поваренной соли, создают великолепные условия для электрохимической коррозии. А при современной толщине автомобильного стального листа это приводит к весьма быстрому его выходу из строя.
Но от коррозии можно не только защищаться броней из лака или хрома, ее можно и обмануть, подсунув в виде приманки такой лакомый кусочек, как металл с более высоким электродным потенциалом.
О катодной защите кузова ранее писалось в здесь>>> но в этот раз немного дополним эту статью.
Ржавчина - враг номер один почти любого металла. «Рыжая чума», с завидным упорством и постоянством превращающая сотни тонн сверкающей высокосортной, легированной стали в груды коричневого порошка. Болезнь, для которой не существует преград... Но существуют лекарства и от нее: гальванические покрытия, лаки и краски, битумы и мастики - все они в принципе должны защитить металл. Но на деле все не так просто.
Очень остро проблема защиты от коррозии стоит, к примеру, перед автомобилистами. Общеизвестно, что если не принимать определенных мер, то кузов автомобиля в течение четырех-пяти лет может превратиться буквально в ржавое решето. Зачастую не помогают ни лакокрасочные покрытия, ни мастики, поскольку кузов имеет немало закрытых полостей, пазух, карманов, коробов, в которых дорожная грязь и сырость, замешанные на поваренной соли, создают великолепные условия для электрохимической коррозии. А при современной толщине автомобильного стального листа это приводит к весьма быстрому его выходу из строя.
Но от коррозии можно не только защищаться броней из лака или хрома, ее можно и обмануть, подсунув в виде приманки такой лакомый кусочек, как металл с более высоким электродным потенциалом.
Электродный потенциал? А какое он, собственно, имеет отношение к коррозии металлов? Оказывается, самое непосредственное.
Если опустить в сосуд с электролитом два электрически связанных между собой металлических электрода, то один из них начнет растворяться, другой же останется в неприкосновенности. Так вот, оказывается, растворяется металл, электродный потенциал которого выше. Это свойство гальванической пары и дало возможность использовать эффект сохранения катода для предохранения от электрохимической коррозии кузова автомобиля.
Судостроители давно уже используют этот принцип предохранения внутренней части трюма от коррозии - они размещают внутри корпуса специальные металлические аноды (из металла с более высоким электродным потенциалом, чем у металла корпуса). Этот способ недавно взяли на вооружение и автомобилисты.
Для анодной защиты применяют оребренные (для увеличения поверхности) куски цинка С помощью вделанных в них постоянных магнитов они прикрепляются в наиболее труднодоступных и загрязняемых местах кузова. Электрическая связь осуществляется многожильным проводом: с помощью винтов цинковый анод подсоединяется к кузову.
На его ребрах собирается дорожная грязь, влага, поваренная соль и комплект «цинк - сталь» начинает работать так, как работает всем известный гальванический элемент. При работе такой «батареи» происходит растворение цинкового анода, катод в данном случае не расходуется.
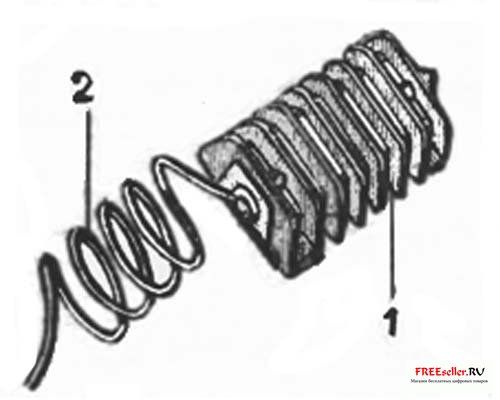
Рис. 1. Комплект для анодной защиты кузова автомобиля:
1 - оребренный цинковый электрод, 2 - соединительный провод.
Процесс коррозии напоминает работу гальванического элемента, поскольку сталь представляет собой, в основном, сплав железа и углерода, то есть веществ с различными электродными потенциалами. При попадании на поверхность такого сплава электролита между молекулами железа и углерода начинает идти электрохимическая реакция, сопровождающаяся растворением анода (железа) и переходом его в гидраты, а затем и в окислы.
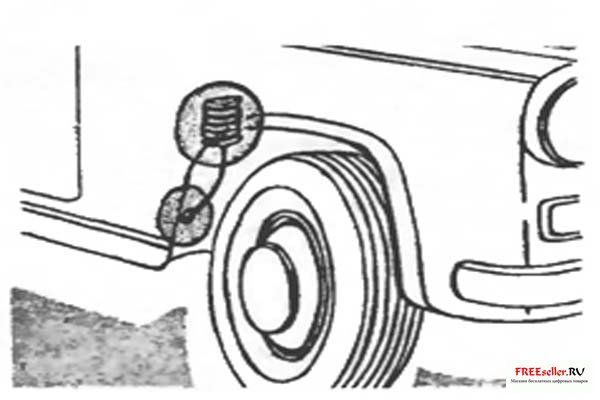
Рис. 2. Установка электрода в колесной нише.
Присутствие же электрически связанного с основным металлом цинкового электрода в корне меняет картину. По отношению, как к железу, так и к углероду цинк представляет собой металл с более высоким электродным потенциалом, то есть выступает в роли анода. Поэтому при наличии электропроводной среды, которая практически всегда присутствует на поверхностях автомобильного кузова, электрохимическая реакция идет с растворением анода (цинка), при сохранении катода, то есть металла кузова.
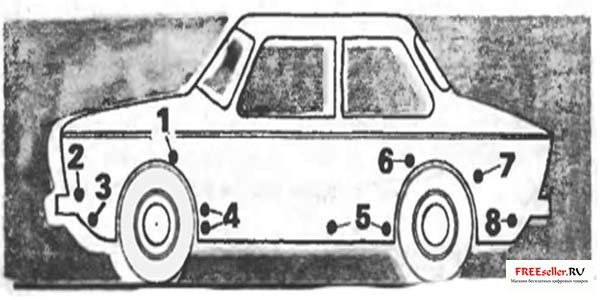
Рис. 3. Установка электродов в этих точках наиболее эффективна:
1 - коробчатые усилители брызговиков, 2 - места крепления корпусов фар и подфарников, 3 - нижняя часть передней панели, 4 - полости за щитками-усилителями передних крыльев, 5 - внутренние поверхности дверей, 6, 7 - передняя нижняя часть заднего крыла и арка колеса по стыку с крылом, 8 - фартук задней панели.
Как показали эксперименты, цинкового электрода величиной со спичечную коробку хватает на 3-5 лет.
Обманите «рыжую чуму». Подсуньте ей приманку - кусочек металла с электродным потенциалом выше, чем у стали. Коррозия охотно вцепится в него, забыв про кузов вашего автомобиля как минимум на три год.